
研究主題:鉻補充改善腦中風後腦梗塞與高血糖的症狀
摘要
急性腦中風伴隨高血糖是相當常見的,不過這也是個嚴重的問題。因此瞭解壓力性高血糖將可有效的預防及治療腦中風。鉻是一種必需微量元素,它可以優化胰島素的功能,使碳水化合物及脂質正常代謝。而除了它的對代謝的功效外,鉻作為膳食補充劑對其他疾病也有有益的效果,尤其是糖尿病相關的併發症。在這項研究中,我們調查了缺血性腦中風大鼠伴隨高血糖與鉻移動的關係及補充鉻後是否可改善缺血性腦中風造成的腦損傷。腦中風大鼠會出現腦梗塞、高血糖、高胰島素血症、葡萄糖耐受不良及胰島素阻抗。腦中風後高血糖常伴隨反調節激素 (counter-regulatory hormone) 升高,包括升糖素、皮質酮、正腎上腺素、降低骨骼肌中胰島素訊號及增加肝臟糖質新生。相關研究顯示,反調節激素的分泌與血糖的上升和鉻流失有正相關性。每日補充鉻在腦中風大鼠中可以增加組織中鉻的含量、減低腦梗塞、改善高血糖、降低升糖素和皮質酮濃度。我們的研究結果顯示,大鼠腦中風伴隨高血糖可能是由於組織中的鉻分佈減少及尿鉻流失所引起。
簡介
許多遭受急性損傷的患者,如腦中風,即使沒有被確診出糖尿病,也多半有中度到重度的高血糖。臨床和動物研究都指出,腦中風後高血糖會增加腦梗塞機率和死亡率,甚至是增加神經系統惡化。然而,早期積極的胰島素治療是有爭議性的,因為會導致嚴重的低血糖 (Capes et al. 2001; Rosso et al. 2015)。這些現象更凸顯出,腦中風伴隨壓力性高血糖預防與治療的重要性。而腦中風後高血糖是由許多因素所構成。研究顯示它可能與反調節激素 (升糖素、兒茶酚胺、皮質酮) 干擾胰島素作用有關,這些荷爾蒙會促進發炎反應,如增加肝臟葡萄糖生成、降低周圍葡萄糖攝取而引起高血糖 (Dungan et al. 2009; Harada et al. 2009; Lindsberg and Roine 2004; Wang et al. 2011, 2013, 2014)。因此,控制反調節激素可能有助於增加並強化胰島素的敏感性,進而改善伴隨高血糖的症狀。
三價鉻在正常的碳水化合物、脂質和蛋白質代謝中是一個必需的微量元素 (Pechova and Pavlata 2007)。補充鉻在糖尿病患者中可以提高葡萄糖的代謝,反之,鉻缺乏會加重病情 (Balk et al. 2007; Cefalu and Hu 2014)。證據顯示葡萄糖代謝的改善,乃因於鉻增強了胰島素的作用 (Chen et al. 2009; Cefalu and Hu 2014)。而過度刺激的交感神經系統和過量的發炎因子,會產生壓力性高血糖 (Wang et al. 2011, 2014)。人類和動物研究顯示,飲食和環境壓力因素會引起反調節激素分泌增加及產生鉻流失 (Anderson et al. 1982, 1991; Borel et al. 1984)。研究證據表明,補充鉻可以降低反調節激素分泌、降低氧化壓力和發炎反應 (Samanta et al. 2008; Al-Rasheed et al. 2013)。但是,目前鉻是否可改善腦中風後的葡萄糖代謝仍未知。
因為鉻具有調節葡萄糖代謝的生物活性,我們推測鉻可能可以對腦中風引起的高血糖發揮作用。而先前研究證實,在缺血性腦中風的大鼠動物模式中會引起高血糖的症狀 (Wang et al. 2011, 2013, 2014)。為了增加相關的研究範圍和瞭解腦中風後高血糖,本研究調查大鼠缺血性腦中風伴隨高血糖與鉻移動的關聯性。其實,糖尿病是腦中風病患最麻煩的問題 (Tziomalos et al. 2014),不過也有許多證據說明,鉻補充可以改善許多疾病,包括糖尿病引起的併發症 (Pei et al. 2006; Chen et al. 2009; Ulas et al. 2015)。因此補充鉻是否有益於預防腦中風伴隨高血糖的影響,也是本研究的另一個重點。
材料方法
動物和誘導缺血性腦中風模式
國立中興大學實驗動物管理與使用委員會核准本實驗動物研究。本研究先利用3 % isoflurane麻醉雄性Sprague-Dawley大鼠 (280–350 g),並使用加熱板保持動物體溫於37.0 ± 0.5 °C,接著進行手術閉鎖頸總動脈及右中腦動脈,造成缺血性腦中風 (Wang et al. 2011),假手術組以同樣步驟進行手術,但無進行動脈閉鎖。所有的分析在手術24小時後進行。
實驗設計與大鼠補充鉻
實驗隨機分成三組,假手術組 (無缺血性腦中風),連續三週口服安慰劑;缺血性腦中風組,連續三週口服安慰劑;缺血性腦中風補充鉻組,連續三週口服乳鉻奶粉 (trivalent chromium dose: 80 μg/kg BW/day)。給藥的劑量與途徑依照先前研究進行 (Chen et al. 2009)。乳鉻奶粉由 Maxluck Biotechnology Corporation, Taipei, Taiwan (Pei et al. 2006) 所提供。
尿液、血液及組織樣本的收集
犧牲前,大鼠飼養於代謝籠中收集尿液,並在組織摘除前12小時取出動物飼料。血液樣本由左股動脈收集,而肝臟、腓腸肌和附睾脂肪收集後置於 ─80℃冷凍。
大鼠腦血栓的檢測
大鼠在安樂死後取出大腦,並將大腦切成2 mm厚度的切片。而切好的正常及腦血栓的大腦被浸泡於37 °C 的2% 2,3,5- triphenyltetrazolium chloride (TTC) 溶液30分鐘,接著用10 % phosphate-buffered formalin 固定 45 分鐘。血栓的區域面積利用電腦軟體計算 (Alpha Innotech, IS1000, San Leandro, CA)。
檢測葡萄糖耐受性
禁食大鼠腹腔注射葡萄糖 (2 g/kg body weight) 後,採取尾靜脈血液檢測血糖值,血糖機使用 Accucheck glucometer (Roche Diagnostics, Indianapolis, IN)。並計算曲線下的總面積 (AUC) ,其為葡萄糖注射後2小時血糖 AUC。
荷爾蒙分析
血清胰島素 (Shibayagi, Gunma, Japan)、升糖素 (R&D Systems, Minneapolis, MN)、正腎上腺素 (LDN, Nordhorn, Germany) 由 ELISA kit 進行分析,分析方法由製造商所提供。
Homeostasis model assessment (HOMA)
檢測胰島素阻抗情形 (Matthews et al., 1985)。HOMA-IR 指數計算公式為 [fasting insulin (禁食胰島素值) (μU/ml) x fasting glucose (禁食血糖值) (mmol/l)]/22.5。
鉻濃度分析
組織前處理經65 % nitric acid 消化並加熱65 °C一小時可溶出鉻離子 (Gunton et al. 2001)。鉻離子檢測依據石墨爐原子吸收分析分光光度法 (Hitachi Z-2000 series polarized Zeeman atomic absorption spectrophotometer)。
組織前製備與西方墨點法
肌肉蛋白質由蛋白質萃取液提取 (T-PER, Pierce Biotechnology, Rockford, IL)。蛋白質藉由電荷原理分離由SDS-PAGE游離至PVDF 膜,並搭配5% 脫脂奶粉與專一性抗體 [insulin receptor substrate-1 (IRS1), IRS1-Tyr896, PI3-k p85α, GAPDH (Santa Cruz Biotechnology, Santa Cruz, CA), Akt, and Akt-Ser473 (Cell Signaling Technology, Danvers, MA] 藉由 ECL 呈色,顯示出蛋白質的含量。
RNA萃取與定量 (RT-PCR)
利用 RNA 萃取液萃取肝臟中的 RNA,並定量組織中 RNA 的濃度,其使用的引子 (Primers) 如下phosphoenolpyruvate carboxykinase (PEPCK), 5′-CAGG AAGTGAGGAAGTTTGTGG and 5′-ATGACACCCTCCTCCTGCAT; glucose-6- phosphatase (G6Pase), 5′-CCATCTGGTTCCACATTCAAGAG and 5′- CAGTGT CCAGGACCCACC and β-actin, 5′-AAGTCCCTCACCCTCCCAAAAG and 5′-AAGCA ATGCTGTCACCTTCCC。
統計
數據利用SPSS軟體分析,差異性統計藉由 Student’s unpaired t-test、Pearson’s correlation 及 one-way analysis of variance (ANOVA) followed by Dunnett’s t-test 進行分析。數據以 means ± SD 表示,p < 0.05 表示有顯著差異。
結果
缺血性腦中風伴隨高血糖症狀
缺血性腦中風大鼠體重與攝食量顯著低於假手術組大鼠,不過鉻補充對體重與攝食量影響很小 (數據未顯示)。假手術組和缺血性腦中風組大鼠的大腦梗塞面積比較圖 (如Fig. 1a)。評估急性腦缺血對葡萄糖代謝平衡的影響,運用幾項指標來做觀察,如缺血性腦中風組和假手術組相比,有較高的禁食血糖值 (Fig. 1b)、胰島素濃度 (Fig. 1c) 與HOMA-IR (Fig. 1d)。此外,葡萄糖耐受性試驗結果顯示,缺血性腦中風大鼠的葡萄糖耐受性較假手術組差 (Fig. 1e和f)。由這些證據顯示,缺血性腦中風之大鼠會產生高血糖、高胰島素血症、葡萄糖耐受不良與胰島素阻抗症狀。
缺血性腦中風增加反調節激素分泌
有證據顯示反調節激素會影響葡萄糖代謝產生高血糖 (Mizock 1995)。因此利用血漿來檢測腦中風大鼠的反調節激素的分泌量。實驗數據顯示,缺血性腦中風組血漿中升糖素、皮質酮與正腎上腺素較假手術組的大鼠高 (Fig. 1g)。由此可知,缺血性腦中風之大鼠會分泌較多的反調節激素。
缺血性腦中風組織的鉻移動
鉻是一種必需微量元素,可以保持體內葡萄糖的動態平衡 (Pechova and Pavlata 2007)。有趣的是,我們想瞭解缺血性腦中風是否會造成組織內的鉻移動。和假手術組相比,缺血性腦中風組的尿鉻排出量增加,血清、腓腸肌與脂肪組織中的鉻濃度就會相對較低。不過出乎意料的是,肝臟中的鉻濃度並沒有顯著差異 (Fig. 1h)。結果顯示,缺血性腦中風會導致大鼠體內鉻流失,並由尿液排出。
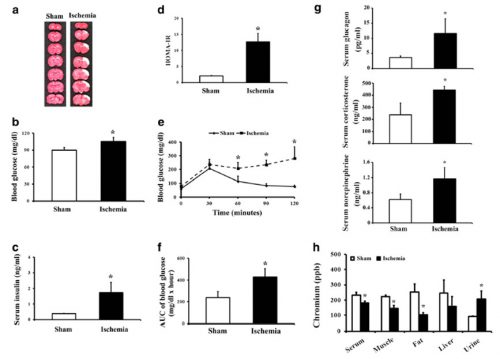
圖一、缺血性腦中風引起的高血糖。(a) 透過TTC染色,顯示出假手術組與缺血性腦中風組腦梗塞的情況。收集血液樣本檢測空腹血糖值 (b)、胰島素 (c) 與 HOMA-IR (d)。葡萄糖耐量試驗檢測每個階段的血糖值 (e) 與計算曲線下面積(areas under the curve, AUC) (f)。檢測血清中升糖素、皮質酮與正腎上腺素 (g)。血清、腓腸肌、附睾脂肪、肝臟及尿鉻濃度 (h)。*p < 0.05 和假手術組相較 (每組六隻)。
反調節激素與組織鉻濃度關係
有證據指出壓力性荷爾蒙是潛在導致鉻流失的原因之一 (Anderson et al. 1982, 1991; Borel et al. 1984)。因此,我們檢測在急性腦中風大鼠體內反調節激素的分泌與鉻流失之間的關聯性,並以血清鉻濃度與尿鉻排出量來觀察。結果顯示,血清中的升糖素與皮質酮和血清中的鉻濃度呈現負相關 (Fig. 2a)。而有顯著的正相關性,則呈現在尿鉻濃度與血清中升糖素、皮質酮與正腎上腺素 (Fig. 2b)。這些結果顯示,鉻排出量與反調節激素的分泌有相關性。
鉻濃度與血糖的相關性
越來越多證據顯示,第2型糖尿病罹患率與體內低鉻濃度有關 (Ekmekcioglu et al. 2001)。因此,我們檢測在急性腦中風大鼠體內的鉻排出和流失是否與血糖值相關,並以血糖濃度和組織鉻濃度分析比較。血糖的上升與尿鉻排出量成正比,相反地,血糖濃度與血清鉻和腓腸肌組織鉻濃度則呈現負相關。但是,肝臟以及附睾脂肪中的鉻含量,在統計上沒有顯著差異 (Fig. 2c)。這些證據顯示,鉻的排出量與高血糖有相關性。
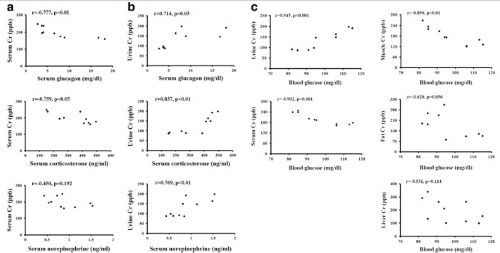
圖二、反調節激素、血糖與鉻濃度的相關性。檢測血清鉻、尿鉻、血糖及血清中升糖素、皮質酮與正腎上腺素。並評估血清鉻 (a)、尿鉻 (b) 與反調節激素的相關性。及評估血糖與組織鉻濃度的相關性 (c)。N = 10。
鉻補充降低腦中風後的梗塞面積和高血糖
鉻缺乏和缺血性腦中風產生的腦梗塞與高血糖有相關性,而在鉻補充後呈現了有利的實驗結果。對腦中風的大鼠每日補充鉻持續三週,會增加組織中的鉻含量 (Fig. 3a)。鉻補充會降低腦中風大鼠腦梗塞面積 (Fig. 3b and c)、禁食血糖、胰島素濃度、胰島素阻抗、升糖素與皮質酮 (Table 1) 和改善葡萄糖耐受性 (Fig. 3d and e)。但正腎上腺素濃度沒有改變 (Table 1)。肝臟糖質新生與骨骼肌的葡萄糖吸收主要負責調節胰島素作用與葡萄糖代謝平衡 (Stump et al. 2006)。為了進一步探討補充鉻可以預防腦中風大鼠高血糖,實驗透過對胰島素敏感的組織肝臟與腓腸肌來瞭解其中代謝機制。利用西方點墨法 (Western blot) 分析肌肉組織 (Fig. 3f)。結果顯示缺血性腦中風組和假手術組相較,有缺血性腦中風組較低的IRS1 tyrosine phosphorylation (P-IRS1-Tyr)、PI3-k p85α和Akt phosphorylation (P-Akt) 表現量。在RT-PCR的檢測結果,缺血性腦中風組的肝臟糖質新生基因 (PEPCK與G6Pase) 的表現均較假手術組高 (Fig. 3g)。而這些情況在缺血性腦中風組大鼠補充鉻之後都可被改善 (Fig. 3f and g)。綜合上述結果,缺血性腦中風會引起周邊胰島素作用降低骨骼肌葡萄糖吸收及增加肝臟葡萄糖的產生,而補充鉻可以增強周邊胰島素的作用並降低缺血性腦梗塞面積。
